〔摘要〕目的:建立稳定表达BMPs II型突变受体的NIH3T3细胞株。方法:用FuGENE6 Transfection Reagent Kit真核转染试剂盒将携带BMPs II型突变受体的cDNA的真核表达载体转染NIH3T3细胞。结果:得到抗G-418的阳性细胞克隆转染细胞,neo基因原位杂交阳性。结论:成功建立了稳定表达BMPs II型突变受体的NIH3T3细胞株。
骨形成蛋白(BMPs)不仅在骨,软骨及与骨骼有关的结缔组织的形成上有重要作用 ,而且在胚胎发育、器官形成及细胞分化中起着十分重要的调控作用〔1,2〕。与其它TGF-β超家族成员一样,BMPs在细胞表面与BMP的I、II型受体相互作用,I型受体可以和过量的配体结合,而II型受体与配体的结合则是特异性的〔2〕。为研究BMPs信号转导在组织发育和细胞分化中的作用,我们以BMPs II型突变受体的基因为目的基因,以小鼠成纤维细胞为载体细胞,建立了稳定表达BMPs II型突变受体的细胞,从而为进一步从信号转导水平探讨BMP对细胞分化及组织器官发育的调控奠定了基础。
1 材料和方法
1.1 材料
pC-4质粒为含有BMPs II型突变受体cDNA(cDNA由日本Kawasaki医学院分子生物所的Nohno教授提供)的真核表达载体(由本实验室构建);FuGENE6 transfection reagent kit 为Boehringer Mannheim公司产品;G-418为Gibco公司产品; NIH3T3细胞由西京医院刘松波博士提供;neo基因探针由本实验室岳文博士提供。
1.2 NIH3T3细胞的培养
NIH3T3细胞,用含体积分数为10%胎牛血清的DMEM培养液,在37 ℃、体积分数为5%CO2、饱和湿度下培养,3 d换液1次,传代3到4次使细胞达到良好的生长状态。
1.3 BMPs II型突变受体基因的转染
①转染前一天传代到6孔培养板(3×105,2 ml培养液),在转染时细胞密度达到50%~ 80%(面积百分比);②取消毒的EP管1支,加入无血清培养液100 μl,再加入Fugene6 Transfection 试剂5 μl;③室温孵育5 min;④加入克隆有转染基因的质粒DNA 1.5 μg到另1支EP管中,体积为5 μl;⑤将②EP管中孵育好的试剂加入到④EP管中,轻弹使其混匀,室温孵育15 min;⑥将①培养板的培养液吸弃,然后将⑤中孵育好的试剂滴加入到培养孔内,轻轻转动使其均匀分布;⑦在CO2孵箱中继续培养48 h;⑧将细胞传代至培养瓶中,加入G-418 300 mg/L 进行筛选,3 d换液1次;设未转染细胞对照;⑨2周后转染细胞出现克隆性生长,用胰酶消化法转移细胞克隆,扩大培养,用Cytospin甩片机制备细胞甩片,固定于40 g/L多聚甲醛(含体积分数的1‰ DEPC)16 h,-20 ℃保存备用。
1.4 转染后鉴定
1.4.1 neo基因探针的制备 用Hind Ⅲ和ClaⅠ双酶切质粒pDOR(neo),回收1.9 kb的片段,得到neo基因,用随机引物法标记探针。
1.4.2 原位杂交 转染细胞甩片经体积分数0.3% Triton-100、0.2mol/L HCL及蛋白酶K处理,40 g/L多聚甲醛(含体积分数为1‰ DEPC)后固定,逐级酒精脱水干燥,滴加热变性的含neo基因探针的杂交液,42 ℃过夜;2×SSC、1×SSC、0.5×SSC漂洗,正常羊血清封闭,滴加标记碱性磷酸酶的抗地高辛抗体37 ℃,2 h;BufferⅠ、BufferⅢ漂洗,NBT/BCIP暗处显色。
1.4.3 设未转染细胞对照。
2 结 果
2.1 细胞克隆
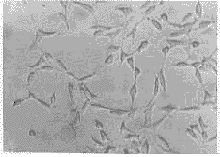
转染细胞经G-418筛选,2周后得到抗G-418的阳性细胞克隆,而未转染细胞在含G-418的培养液中逐渐全部死亡,初步证明BMPs II型突变受体基因的转染成功(见图1)。
图1 转染细胞阳性克隆(倒置显微镜×100)
2.2 neo基因原位杂交
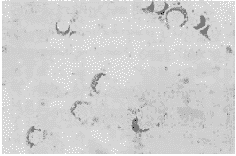
在转染细胞的胞浆中有蓝色颗粒样阳性杂交信号(图2),进一步证明BMPs II型突变受体基因的转染NIH3T3细胞成功,并有BMPs II型突变受体mRNA的表达;未转染细胞未见阳性信号(图3)。
图2 转染细胞(原位杂交×200)
相关阅读:
 发表评论
发表评论 用户评论
用户评论